大手VCのFlagship Pioneeringの主導によって設立された企業。Engineered tRNA分子を医薬品として開発するアプローチを取り、ナンセンス変異によって翻訳が途中でストップして起こる様々な疾患に対して、標的となるナンセンス終始コドンに結合し、WT遺伝子がコードしていたアミノ酸を取り込ませ、全長タンパク質が翻訳されるようにする。プラットフォーム技術のコアとなる部分は詳細が開示されていないが、様々な修飾を施した様々な配列の人工tRNA分子を化学合成と酵素による処理を併用することで合成し、それらのtRNA分子をハイスループットに自動化されたアッセイで活性、特異性、分子の安定性、免疫原性の低さなどを評価し、それらのパラメーターを最適化したtRNA分子の配列・塩基修飾パターンを予測する機械学習モデルを構築している。RNA分子の修飾を柔軟に行うため、tRNAの化学合成べースの製造プロセスを自社で開発している。開発戦略として、単一の人工tRNA医薬品を用いて、複数のナンセンス変異を病因とする疾患をまとめて治療する戦略を取っている。リード品は肝臓でArgコードmRNA配列がTGA終始コドンとなるナンセンス変異を対象としており、フェニルケトン尿症、有機酸血症、尿素サイクル異常症などをまとめて治療するバスケット臨床試験を実施する予定であることを総説論文で説明している。
Cambridge, Massachusetts, United States
この企業の詳細情報の作成をご希望の方は、お気軽にリクエストください
設立 2018 年 | 推定従業員数 11-50 名 | 累計調達額 $159M Ave:155.4M Med:22.5M | 提携企業数 2件 Ave:3.3 Med:1 | 論文数 5件 Ave: 13.2 Med: 4 | 特許数 0件 Ave: 13.2 Med: 4 |
テクノロジー
tRNA platform
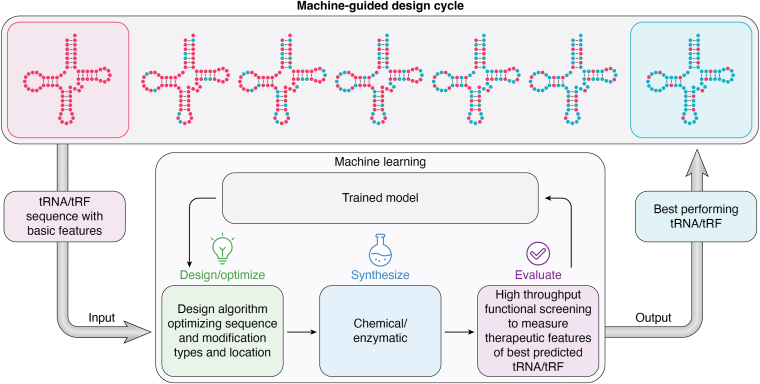
医薬品候補となる人工tRNA分子を探索する技術。
技術のコアとなる部分の詳細は開示されていないが、Alltrna社から2023年に報告された総説で技術や介入アプローチの概要が紹介されている。
まず、人工tRNA分子を用いることで取れる治療戦略(Fig.2)として、CGA→UGAなどのナンセンス変異となるPTC(premature termination codon)に対して、UGAを認識して結合し、かつWTの遺伝子がコードするアミノ酸を組み込むtRNA分子を用いることで、全長タンパク質の翻訳を誘導することができる。
また、フレームシフト変異については、例えば4塩基を認識する人工tRNA分子を用いることで、挿入された1塩基の影響を無にしてWTの全長タンパク質の翻訳を誘導することができる。
一塩基変異についても、遺伝子編集をすることなく変異した塩基を含むコドンを認識してWTのアミノ酸を組み込むようなtRNAを用いて変異の影響を無にすることができると考えている。
それらの治療薬候補となるtRNAの探索では、機械学習モデルを構築することで効率的な探索を可能としている。詳細は開示されていないがFig.3で概念図が示されており、機械学習によって候補tRNAの配列と修飾パターンを予測することで候補分子を設計し、ハイスループットな評価を行い、その試験結果をモデルの改善に活用している。結果として特定されたtRNAのリード分子は、リガンド修飾tRNAとして、もしくはLNPにローディングして標的組織にデリバリーを行い、In vivoでの活性、PD/PKの評価に進む。
Fig.6でも機械学習モデルについて触れられており、機械学習モデルでtRNAのデザインを行い、化学合成や酵素処理を併用して合成し、評価の際には活性(例えばPTCリードスルー活性)だけではなく、tRNA構造、分子の安定性、毒性、免疫原性などのパラメーターも評価することで、これらのパラメーターを最適化したtRNAをデザインできるようにしている。
プレスリリースでは、機械学習モデルに基づくtRNA分子の設計によって、活性が約100倍に増強できたことを報告している。
また、学会発表の要旨などの情報を特定できなかったが、TIDES 2024では"Building 3-D homology models to support tRNA structure-based drug design"とのタイトルで発表を行っており、3次元構造が類似するような人工tRNA分子をデザインできることが伺える。
なお、tRNAは様々なtRNA配列が存在し、そのプールとして細胞で発現しているが、細胞の種類やストレス・疾患状態にさらされることなどによって特定のtRNAの発現が増減することが知られており、内在性の量が減ってしまうtRNAや、元々量が少ないtRNAを補充することも治療戦略として成り立つことに言及している(Fig.4)。
Flagship Pioneering社の名義で2020年に申請された特許では、特定のSNPを持つことで(アミノ酸の変化は伴わないが)元々量が少ないtRNAを使用することになってしまったsynonymous mutation codonを持つ患者に対して、そのtRNAを補充する戦略が示されている(Fig.3)。
パイプラインの情報から、人工tRNAをLNPにローディングして肝臓に送達する研究を先行させていることが伺える。
パイプライン名 | 開発フェーズ | 対象疾患 | 標的分子/作用機序 | モダリティ | パートナー企業 |
|---|---|---|---|---|---|
Arg-TGA | 探索 非臨床 P1 P2 P3 申請 上市 | Phenylketonuria (PKU),Urea Cycle Disorders,Organoic Acidemia | tRNA therapy (Arg-TGA nonsense mutation readthrough) | 核酸医薬 | Moderna |
Gln-TAG | 探索 非臨床 P1 P2 P3 申請 上市 | Phenylketonuria (PKU),Urea Cycle Disorders,Organoic Acidemia | tRNA therapy (Gln-TAG nonsense mutation readthrough) | 核酸医薬 | |
Other nonsense mutations | 探索 非臨床 P1 P2 P3 申請 上市 | Liver disorders | tRNA therapy (nonsense mutation readthrough) | 核酸医薬 | Moderna |
提携企業
提携企業 | 日付 | プレスリリース |
|---|---|---|
Flagship Pioneering | 2023-08-09 | |
Moderna | 2021-11-09 |
Alltrna と似ている企業
内在性のADAR(RNAのA-to-I置換を行う酵素)をリクルートするgRNA分子技術を持ち、遺伝子編集治療薬を開発する企業。突然変異を持つRNAの一塩基編集(RNAfix)や、mRNAの終止コドンを認識し翻訳を継続させる修飾tRNA分子技術(RNA Skip)、および詳細非開示の編集タイプのRNAswap技術を保有する。University of California San Diego(UCSD)のPrashant Mali教授の研究成果が活用されており、2022年の論文ではstem loop配列を含む環状のRNA分子(circular ADAR-recruiting guide RNAs : cadRNAs)が内因性のADARによる遺伝子編集効率を大幅に高めることを報告している。また、特定の組織指向性を持ったAAVベクターの探索のため、カプシド改変を行ったAAVライブラリを非ヒト霊長類に投与しIn vivo screeningによって目的の組織で濃縮されるAAVベクターを特定する技術を保有する(AAVid)。プレスリリースなどの情報から、中枢神経疾患、肝疾患、眼科、筋疾患の領域でパイプラインを持つことが伺える。

